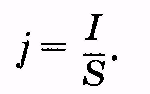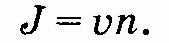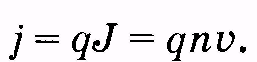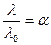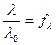Все ткани организма пропитаны и омываются биологическими жидкостями, в которых растворены сильные и слабые электролиты. Поэтому такие биологические жидкости как кровь, лимфа, спинномозговая жидкость, слезная жидкость, слюна и т.д. относятся к проводникам второго рода.
В растворах электролитов сольватированные ионы находятся в беспорядочном движении. При наложении электрического поля возникает упорядоченное движение ионов к противоположно заряженным электродам.
Сравнение скоростей движения различных видов ионов производят при градиенте потенциала поля 1 В/м. Для этих условий скорость движения ионов называют абсолютной, обозначают буквой w и выражают в м 2 ×B –1 ×c –1 . Абсолютная скорость движения иона –– это расстояние в метрах, которое проходит ион за 1 с при градиенте потенциала 1В/м. Численные значения абсолютных скоростей движения ионов в данном растворителе зависят только от их природы и температуры.
Для оценки способности ионов к перемещению под действием внешнего поля пользуются также количественной характеристикой – подвижность ионов (U). Подвижность иона представляет собой произведение числа Фарадея (F = 96465 B×с×См×моль –1 ) на абсолютную скорость движения иона и выражается в См× м 2 ×моль –1 :
U = F×w (1)дельной электрической проводимостью называется электрическая проводимость 1м 3 раствора, находящегося в однородном электрическом поле при напряженности 1 В/м. Единицей удельной проводимости в CИ служит сименс/метр (См/м). Удельная электрическая проводимость зависит от многих факторов и, прежде всего, от природы электролита, его концентрации и температуры. Изотермы удельной электрической проводимости (рис.1) дают представление о характере зависимости удельной электрической проводимости от природы электролита и его концентрации для 25 0 С (298К). Анализ изотермы позволяет сделать следующие выводы:
1. Удельная электрическая проводимость максимальна для растворов сильных кислот и несколько меньше – сильных оснований, что объясняется полной диссоциацией этих электролитов и высокой подвижностью ионов Н3О + и ОН – .
2. Наименьшие значения во всем диапазоне концентраций имеет удельная электрическая проводимость растворов слабых электролитов (СН3СООН) в связи с низкой концентрацией ионов (a
Дата добавления: 2016-01-16 ; просмотров: 1428 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Биологические жидкости являются электролитами, электропроводимость которых имеет сходство с электропроводимостью металлов: в обеих средах, в отличие от газов, носители тока существуют независимо от наличия электрического поля.
В этих средах под воздействием электрического поля возникает упорядоченное (направленное) движение свободных электрических зарядов (электронов, ионов) — электрический ток. Скалярной характеристикой электрического тока является сила тока (I), равная отношению заряда (q), переносимого через сечение проводника или некоторую поверхность за интервал времени t к этому интервалу:
Если электрический ток равномерно распределен по сечению проводника, то отношение силы тока к площади сечения проводника (S) называется плотностью тока (j):
удельная проводимость электролита тем больше, чем больше концентрация ионов, их заряд и подвижность. При повышении температуры возрастает подвижность ионов и увеличивается электропроводимость.
Установим связь плотности тока с некоторыми характеристиками носителей тока
была установлена связь между плотностью потока вещества, молярной концентрацией и скоростью направленного движения частиц [см. (11.26)]. Запишем эту формулу для плотности потока частиц, заменив молярную концентрацию с концентрацией п:
Если эту формулу умножить на заряд q носителя тока, то произведение qJ будет соответствовать заряду, проходящему через единицу площади сечения за одну секунду, т. е. будет являться плотностью тока:
Биологические ткани и органы являются довольно разнородными образованиями с различными электрическими сопротивлениями, которые могут изменяться при действии электрического тока. Это обусловливает трудности измерения электрического сопротивления живых биологических систем.
Электропроводимость отдельных участков организма, находящихся между электродами, наложенными непосредственно на поверхность тела, существенно зависит от сопротивления кожи и подкожных слоев. Внутри организма ток распространяется в основном по кровеносным и лимфатическим сосудам, мышцам, оболочкам нервных стволов. Сопротивление кожи, в свою очередь, определяется ее состоянием: толщиной, возрастом, влажностью и т. п.
Электропроводимость тканей и органов зависит от их функционального состояния и, следовательно, может быть использована как диагностический показатель. Так, например, при воспалении, когда клетки набухают, уменьшается сечение межклеточных соединений и увеличивается электрическое сопротивление; физиологические явления, вызывающие потливость, сопровождаются возрастанием электропроводимости кожи и т. д.
Электрофорез лекарственных веществ
Человеческий организм в значительной степени состоит из биологических жидкостей, содержащих большое количество ионов, которые участвуют в различных обменных процессах.
Под влиянием электрического поля ионы движутся с разной скоростью и скапливаются около клеточных мембран, образуя встречное электрическое поле, называемое поляризационным. Таким образом, первичное действие постоянного тока связано с движением ионов, их разделением и изменением их концентрации в разных элементах тканей.
Воздействие постоянного тока на организм зависит от силы тока, поэтому весьма существенно электрическое сопротивление тканей и прежде всего кожи. Влага, пот значительно уменьшают сопротивление, что даже при небольшом напряжении может вызвать значительный ток через организм.
Непрерывный постоянный ток напряжением 60—80 В используют как лечебный метод физиотерапии (гальванизация).
Источником тока обычно служит двухполупериодный выпрямитель — аппарат для гальванизации. Применяют для этого электроды из листового свинца или станиоля толщиной 0,3—0,5 мм. Так как продукты электролиза раствора поваренной соли, содержащегося в тканях, вызывают прижигание, то между электродами и кожей помещают гидрофильные прокладки, смоченные, например, теплой водой.
Дозируют силу постоянного тока по показаниям миллиамперметра, при этом обязательно учитывают предельно допустимую плотность тока — 0,1 мА/см 2 .
Постоянный ток используют в лечебной практике также и для введения лекарственных веществ через кожу или слизистые оболочки. Этот метод получил название электрофореза лекарственных веществ.
Под прохождением электрического тока через вещество подразумевают направленное движение (перенос) электрических зарядов. В зависимости от природы их носителя различают проводники первого рода и проводники второго рода.
В проводниках первого рода перенос электрического заряда осуществляется за счет направленного движения электронов. К ним относятся главным образом сплавы металлов, металлы и их расплавы.
В проводниках второго рода перенос электрического заряда осуществляется за счет направленного движения ионов. К ним относятся все электролиты. Причем в большинстве случаев используются растворы или расплавы данных соединений, так как именно в таких системах за счет действия растворителя или высокой температуры образуются в достаточных количествах свободные ионы, способные перемещаться под действием внешнего электрического поля.
Способность вещества проводить электрический ток количественно характеризуется электропроводностью L, которую можно предсказать как величину, обратную сопротивлению проводника R:
где ρ – удельное сопротивление; 
Электрическая проводимость в растворах электролита зависит от числа ионов в объёме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на неё различных факторов применяют две величины: удельную (Χ) и молярную (λ) электрическую проводимость.
Удельной электрической проводимостью (Χ) называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см 2 , расположенными на расстоянии 1 см (измеряется в См·см -1 или См·м -1 ).Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Молярная электрическая проводимость – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации.
Молярная электрическая проводимость равна электрической проводимости такого объёма (V,см 3 ) раствора, в котором содержится 1 моль растворённого электролита, причём электроды расположены на расстоянии 1 см друг от друга.
Из определения удельной и молярной электрических проводимостей следует, что они связаны соотношением:
где С – концентрация, моль/дм 3 ; λ – молярная электрическая проводимость, См·см 2 /моль; Χ – удельная электрическая проводимость, См/см.
Молярная электрическая проводимость слабых электролитов меньше, чем сильных; так как даже при низких концентрациях степень диссоциации слабых электролитов мала (α‹1). Следовательно, несмотря на то, что в объёме раствора, заключённого между электродами, содержится 1 моль электролита, переносчиков электрического тока – ионов в данном объёме меньше, чем в растворе сильного электролита. Повышение молярной электрической проводимости слабых электролитов при разбавлении растворов связано с увеличением степени диссоциации.
Для слабых электролитов отношение молярной электропроводности раствора при данном разбавлении (λ) к молярной электропроводности при бесконечно большом разбавлении (λº) характеризует истинную степень электролитической диссоциации. Степень диссоциации электролита в растворе заданной концентрации можно рассчитать, измерив молярную электрическую проводимость этого раствора и зная λº.
У слабых электролитов с разбавлением раствора увеличивается степень электролитической диссоциации и молярная электропроводность; константа же диссоциации при неизменной температуре остаётся постоянной величиной (закон разбавления Оствальда). Константа диссоциации Кдис, α, λ и концентрация (разбавление) подобных растворов связаны между собою следующими уравнениями:
Кдис =
Кдис =
Кдис = 
где V=1/C – разбавление раствора, л/г-экв.
Для сильных электролитов, диссоциирующих полностью (α=1),
Уменьшение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций у сильных электролитов связано только с уменьшением скоростей движения ионов. Сильные электролиты не подчиняются закону разбавления.
Биоткани — это проводники II рода.
При наличии разницы электрического напряжения на двух токах металлического проводника электрический ток пойдет в нем от точки, имеющей большой потенциал, к точке с меньшим потенциалом (ток течет). Если эта разница напряжения между точками будет поддерживаться некоторое время, то ток получит одно направление в течение всего этого времени, т.е. по проводнику установится течение постоянного тока. Он будет иметь и постоянную силу в случае, когда разница потенциалов, т.е. электродвижущая сила (напряжение), не будет изменяться.
При прохождении постоянного тока через тело человека возникает постоянное электрическое иоле, т.е. человеческий организм становится сложным электрическим проводником. Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости.
Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость — обладают наибольшей электропроводностью.
К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим — кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса.
Ионное произведение воды.
Вода – слабый электролит, она диссоциирует в незначительной степени (при температуре 298 K на ионы распадается 1 молекула из 5,5х10 8 ). Однако образующиеся при диссоциации воды ионы играют исключительно важную роль в биологических процессах. Поэтому необходимо уметь количественно выражать меру диссоциации воды. Выражение для константы равновесия диссоциации воды:
При температуре 298 К эта величина равна 1,8 х 10 -16 моль/л. Так как диссоциации воды мала, её концентрацию можно считать постоянной и рассчитать по формуле:
где: m – масса 1л воды, Mr – её молярная масса. Подставив числовые значения этих величин в уравнение 1.2, получаем: 1000 г/л / 18 г/моль = 55,5 моль/л. Умножив обе части уравнения 1.1 на концентрацию воды, получаем:
и, подставляя числовые значения, получаем:
К w = 1,8 х 10 -16 моль/л х 55,5 моль/л = 10 -14 моль 2 /л 2 ,
где К w – ионное произведение воды. С ростом температуры увеличивается число диссоциациировавших молекул воды и, следовательно, увеличивается ионное произведение воды.
Если [Н + ] = [ОН — ], то раствор имеет нейтральную реакцию, если преобладают ионы Н + , то раствор кислый, если ОН — – щелочной.
В 1909 г. Зёренсен предложил использовать для выражения концентрации протонов водородный показатель – рН, равный десятичному логарифму концентрации протонов, взятому с противоположным знаком:
Так как ионное произведение воды для данной температуры – величина постоянная, увеличение концентрации одного из ионов влечёт снижение концентрации другого. Зная рН, легко вычислить рОН: рОН = 14 – рН и наоборот.
pH может принимать значения от 1 до 14. Среду со значением рН от 0 до 3 называют сильно кислой, 3-6 – кислой, 7 – нейтральной, 8-10 – слабо щелочной, 11-14 – сильно щелочной.
Биологическое значение постоянства рН состоит в том, что ферменты, контролирующие скорости протекания химических реакций в организме, будучи белками, очень чувствительны к колебаниям рН. Даже незначительный сдвиг реакции среды от оптимума для данного фермента приводит к существенному снижению его биологической активности, а, следовательно, к серьёзным метаболическим нарушениям. Вот почему значения водородного показателя среды поддерживается в узких рамках.
Надо отметить, что сами значения рН в разных частях организма могут существенно отличаться. Так, рН желудочного сока составляет 1,5-2,3; слюны – 6,8; мочи – 5,0-6,5; дуоденального содержимого – 7,6-7,8; крови – 7,36-7,42.
Поддержание оптимального значения реакции среды в различных частях организма достигается благодаря согласованной работе буферных систем и органов выделения.
9. Методы определения рН растворов. Индикаторы.
pH можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
1. Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы. Их преимуществом является дешевизна, быстрота и наглядность исследования.